Na hipótese da inconsistência de informação, persistindo a suspeita de desvio de vacinas, o caminho é a intervenção na saúde pública municipal.
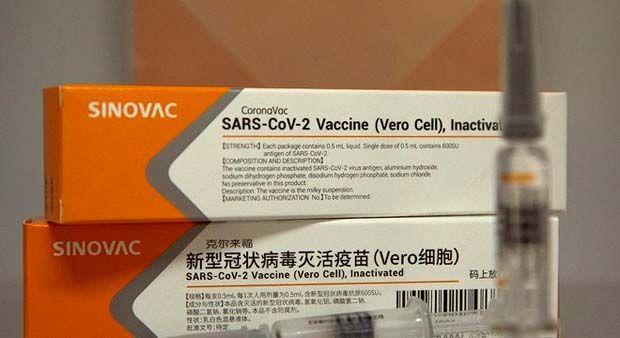
A Agência Nacional de Vigilância Sanitária (Anvisa), suspendeu os estudos clínicos da vacina contra a covid-19 CoronaVac. O anúncio foi feito na noite desta 2ª feira (9.nov.2020). O imunizante é desenvolvido no Brasil pelo Instituto Butantan, de São Paulo, em parceria com a biofarmacêutica chinesa Sinovac Biotech.
Segundo a Anvisa, suspensão ocorre por causa de 1 “evento adverso grave” do dia 29 de outubro, mas não informou o que teria acontecido. Com a interrupção dos testes, nenhum novo voluntário poderá ser vacinado com o imunizante.
O Butantan afirma que foi “surpreendido” pela decisão da Anvisa. Diz que está “apurando em detalhes o que houve com o andamento dos estudos“. Declara estar à disposição para esclarecimentos da agência. Realizará uma entrevista para jornalista na 3ª feira (10.nov), às 11h, na sede do instituto.
O governador de São Paulo, João Doria (PSDB), disse que “lamenta ter sido informado pela imprensa e não diretamente pela Anvisa, como normalmente ocorre em procedimentos clínicos desta natureza, sobre a interrupção dos testes da vacina CoronaVac”.
A Anvisa define como 1 evento adverso grave:
- qualquer suspeita de transmissão de agente infeccioso por 1 dispositivo médico;
- internação hospitalar do paciente;
- morte;
- evento que coloca o indivíduo sob risco imediato de morte;
- incapacidade ou invalidez persistente;
- anomalia congênita ou defeito de nascimento;
- evento clinicamente significante.
Os estudos da CoronaVac foram interrompidos no mesmo dia em que o governo do Estado paulista anunciou que 120 mil doses de vacina chegaram a São Paulo até 20 de novembro.
A CoronaVac está na 3ª fase de testes –a última para garantir a eficácia do imunizante. Em caso de reprovação pela Anvisa, a vacina não poderá ser aplicada no Brasil.
Segundo estudos apresentados pelo governo de São Paulo, 35% dos 9.000 voluntários tiveram reações leves, como dor no local da aplicação, e nenhum efeito colateral grave durante os testes. O resultado significa que a vacina tem “excelente perfil de segurança”, de acordo com o presidente do Instituto Butantan Dimas Covas. “É a vacina mais segura, no momento. Não no Brasil. No mundo”.
ANÚNCIO DA ANVISA
Eis a íntegra da nota da agência:
“Após ocorrência de Evento Adverso Grave* a Anvisa determinou a interrupção do estudo clínico da vacina CoronaVac. O evento ocorrido no dia 29 de outubro foi comunicado à Anvisa, que decidiu interromper o estudo para avaliar os dados observados até o momento e julgar sobre o risco/benefício da continuidade do estudo.
Esse tipo de interrupção é prevista pelas normativas da Anvisa e faz parte dos procedimentos de Boas Práticas Clínicas e esperada para estudos clínicos conduzidos no Brasil.
Com a interrupção do estudo, nenhum novo voluntário poderá ser vacinado. A Anvisa reitera que, segundo regulamentos nacionais e internacionais de Boas Práticas Clínicas, os dados sobre voluntários de pesquisas clínicas devem ser mantidos em sigilo, em conformidade com princípios de confidencialidade, dignidade humana e proteção dos participantes.
A Anvisa mantém o compromisso com o Estado brasileiro de atuar em prol dos interesses da saúde pública.
*De acordo com a RDC 09/2015 são considerados eventos adversos graves:
- a) óbito;
- b) evento adverso potencialmente fatal (aquele que, na opinião do notificante, coloca o indivíduo sob risco imediato de morte devido ao evento adverso ocorrido);
- c) incapacidade/invalidez persistente ou significativa;
- d) exige internação hospitalar do paciente ou prolonga internação;
- e) anomalia congênita ou defeito de nascimento;
- f) qualquer suspeita de transmissão de agente infeccioso por meio de 1 dispositivo médico;
- g) evento clinicamente significante”.
RESPOSTA DO INSTITUTO
“O Instituto Butantan esclarece que foi surpreendido, na noite desta 2ª feira, com a decisão da Agência Nacional de Vigilância Sanitária (Anvisa) e que está apurando em detalhes o que houve com o andamento dos estudos clínicos da CoronaVac.
O Butantan informa ainda que está à disposição da agência reguladora brasileira para prestar todos os esclarecimentos necessários referentes a qualquer evento adverso que os estudos clínicos podem ter apresentado até momento.